Apport des nouvelles technologies dans les explorations des occlusions de branche veineuse rétinienne
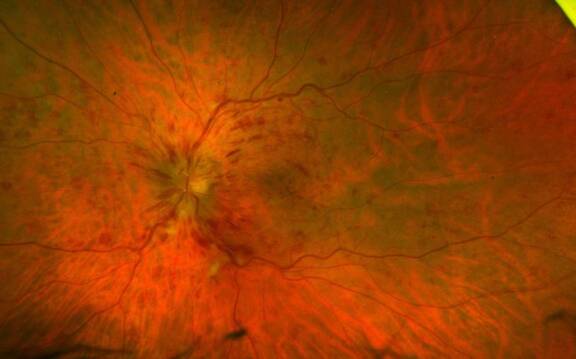
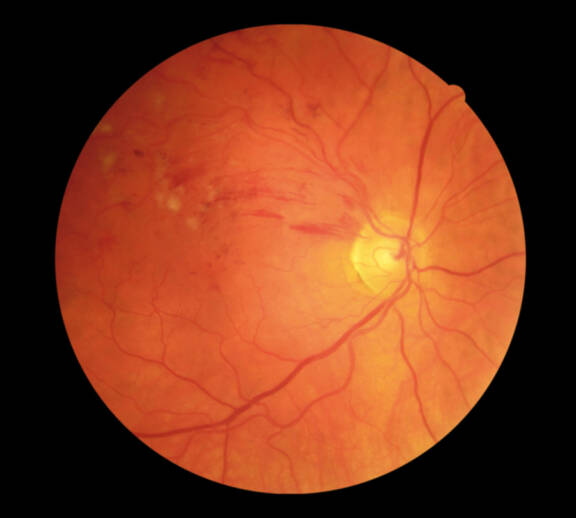
L’occlusion veineuse rétinienne est le deuxième trouble vasculaire rétinien le plus courant après la rétinopathie diabétique et est considérée comme une cause importante de perte visuelle. Le diagnostic clinique de l’occlusion de branche veineuse rétinienne (OBVR) est aisé devant un tableau bruyant fait d’hémorragies rétiniennes striées en flammèches, de nodules cotonneux, dilatation et tortuosité veineuse et œdème rétinien, localisés au territoire rétinien normalement drainé par la veine occluse. Les explorations paracliniques ont tout leur intérêt pour orienter et accompagner la conduite thérapeutique.